ドラッグラグ・未承認薬の本質と改革案
デマに注意!
「日本の薬価は世界的に高すぎる」という人がいるが、それは明らかに誤った情報である。 「日本の薬価が高い」根拠とされている全国保険医団体連合会の公表データは、統計トリックを駆使した浜六郎に歪められたものであることは、日本の薬価は高いのか?に書いた。
実態
欧米で実用から10年以上経過した薬が日本で未だに承認されていない。
卵巣がんの化学療法~日米の違い(2008年2月現在)
薬剤名 米国承認 日本承認 DrugLag カルボプラチン ○(1989) ○(1990) 1年 パクリタキセル ○(1992) ○(1997) 5年 ドキシル ○(1999) × 9年 トポテカン ○(1996) × 12年 ゲムシタビン ○(2006) × 2年 ドセタキセル × ○(2000) - イリノテカン × ○(1994) -
これは氷山の一角である。
他にも実例は沢山ある。
例えば、癌に対する標準治療薬並びに二次薬 - がんと共に生きる会によれば、2001年2月現在の未承認薬にカルチノイド腫瘍のストレプトゾシンがある。
2010年4月27日の第3回 医療上の必要性の高い未承認薬・適応外薬検討会議の資料4-5「医療上の必要性に係る基準」への該当性に関する専門作業班(WG)の評価P.21によれば、転移を有する悪性内分泌腫瘍・神経内分泌腫瘍・カルチノイド腫瘍においてアメリカとフランスで承認済みだが、日本では開発すら開始されていない。
製薬会社には開発の意思ありとされているが、今から開発しても治験には
2〜10年(平均5年)
ドラッグ・ラグ私たちが知っておくべき事・できる事 - NPO法人キャンサーネットジャパン
掛かる。
このような昔ながらの有効な医薬品で日本未承認のものが多数ある。
予備知識
「必要な医療を保険適用すれば良いだけだ、何も難しいことはない」と考える人も少なくないようだが、事はそれほど単純ではない。 まず、必要な医療をどのように評価するのか。
- 科学的根拠を無視して感情論で決める
- 科学的根拠にも基づいて効果や安全性を評価する
前者を採用しても、患者の利益には繋がらない。 医薬品の成功確率は1万分の1程度と言われるので、感情論で決めては有益な療法1に対して無効な療法や有害な療法が9999含まれてしまう。 殆どが無効な療法や有害な療法では、患者にとっての治療上の利益はないし、医療財政的にも大きな無駄使いである。 患者の利益となるよう、有益な療法を確実に承認するためには、科学的根拠に基づいて効果や安全性を評価する必要がある。 では、その科学的根拠となるデータは誰が収集するのか。
- 国が直接データを取る
- 製薬会社にデータを取らせる
前者は共産主義的手法であるが、共産主義が歴史的に成功した試しはない。
東京大学医薬品評価学講座の小野俊介准教授も
そんなバカげた発想は捨てるべき
お金をドブに捨てるのと同義
ドラッグ・ラグ私たちが知っておくべき事・できる事 - NPO法人キャンサーネットジャパン
と酷評する。
国が主導する開発手法では、今以上に、ドラッグラグ・未承認薬問題が深刻化する可能性が高い。
効率的に医薬品・医療器具を開発するには、市場経済の元で自由な開発を保証する必要がある。
ところが、市場経済の元で自由な開発では、利益にならない医薬品・医療器具は切り捨てられる。 利益にならない原因は、販売数量が少ないことと、薬価が安くなりすぎることにある。 前者の例としては、希少疾病医薬品が挙げられる。 後者の例としては、日本の薬価決定システムが薬価を抑制しやすいことが挙げられる。 また、前者・後者に共通する問題として、ジェネリック医薬品の台頭も挙げられる。 これらの欠点をどう解消するか、が国の政策として問われる問題である。
原因
ドラッグ・ラグ私たちが知っておくべき事・できる事 - NPO法人キャンサーネットジャパン(東京大学医薬品評価学講座の小野俊介准教授ら)によると、このページに書いている以上に複雑な事情があるようだ。
しかし、日本の医薬品市場の魅力が乏しいから製薬会社が参入に消極的となっていることは確かなようである。
小野「日本にお薬を持って来る持って来ないというのは、製薬企業ですね、あの世界中の製薬企業が日本でその薬を売りたいかどうかってことに関わってくるわけですけども、その開発の環境ですとか、それから、医薬品を売り始めてからの商売の環境ですね、そういうものが・・・」
小野 「ドラッグラグの話は本質的には、企業の世界におけるビジネス戦略の問題であって、日本の行政が先にくる問題ではありません。 厚労省の制度運用がドラッグラグの原因の一部であることは間違いありませんが、それを企業のグローバル戦略より先に考えるのはどうかと思います。 新薬の世界的な開発状況を見ると、世界の製薬企業が、戦略として日本を後に置いていくのが良いと判断していることは一目瞭然です。 世界レベルでのお金儲けの視点で日本は割に合わないから置いていかれているということですね。 だから、今後ドラッグラグが改善するかという問いに単純に答えると、基本的には全く解決しないというか、今後も状況が自然に良くなる要素はほとんどないと言わざるを得ないところです。 こうした現実の登場人物の行動をきちんと見ずにドラッグラグの対策の話をするとまるで神話の世界になってしまいます。 その辺を踏まえた上で、行政が本来なすべきことをしていないのではないかという指摘も、もちろん当たっていると思います」
ドラッグラグ・未承認薬が発生する直接的な原因は、次の2つに集約される。
- 日本の制度では効能・効果毎の承認を受けないと保険適用されないため、保険診療では承認されていない効能・効果には使えない(効能拡大問題に限る)。
- 未承認医薬品は、何時まで経っても、製薬会社が申請しようとしない。
医薬品の承認に先立って、まず、製薬会社の申請を必要とするのは、日本以外の資本主義国共通の制度である。 国自ら効果のある医薬品を開発することは、共産主義的なやり方だろう。 そして、共産主義的なやり方は、経済的に非効率的であるため、開発においては資本主義よりも不利になる。 よって、ドラッグラグ・未承認薬の問題解決法としては、共産主義的なやり方は本末転倒だろう。
効能拡大
米国では、国が医薬品の製造承認・効能拡大承認を行なっているが、保険適用には特に制限がない。 日本では、効能・効果の追加承認がなければ、原則、保険適用されない(例外はある)。 では、何故、日本は米国のようにしないのか。
効能・効果が疑わしい症例にまで無制限に使われては保険財源の無駄使いになるので、一定の歯止めが必要である。 そして、日本の国民皆保険制度は、国費を投入しており、かつ、国の管理下にある。 そのため、次のような状況に陥ってしまった。
- 国民皆保険制度下では、国が、医薬品の無駄な使用を抑制する制度を作る必要があった。
- 医薬品の無駄な使用を抑制する手段として、長らく、国による効能承認と適応外処方規制以外の手段を用意していなかった。
- それらによる保険適用範囲が広がりにくい問題に対して、自浄作用が働かず、国民も文句を言わなかった。
医療保険財政が厳しいことが原因ではない。 国の責任として医療保険財政の無駄使いを防ぐ必要があるが、その手段が適切ではなかったことが原因である。 そのために、無駄でない使い方まで規制されていたのだ。 (以前の文章は誤読されかねない書き方だったので修正した。) 問題が分かれば対策を講じれば良い。 無駄な使用を抑制しつつ、かつ、保険適用範囲が広がり易い制度を検討すればいい。
製薬会社が消極的
製薬会社が消極的となるのは、日本の医薬品市場の魅力が乏しいからである。
- 日本の制度では効能・効果毎の承認が必要なため、欧米に比べて治験費用が高くつく。
- 健康保険制度では薬価が安く抑えられるため、単位数量当たりの利益が少ない。
- 問題が放置されたことによって発生する副次的な問題として、特許切れの問題がある。(特許制度と医療制度の乖離参照)
治験費用
米国の制度では、国の承認なしに、保険適用が可能なので、同じ成分の医薬品については1度の治験で済む。 しかし、日本の制度では、効能・効果毎に治験が必要となり、治験費用が嵩む。
海外では薬事承認と保険適応は別にしており、一度FDA(米国食品医薬品局)、EMEA(欧州医薬品審査庁)で承認された薬剤の適応外使用での保険適応は、世界各国では形すら違いはあれ、医学の進歩に合わせて、新しいエビデンスが出た時点で順次保険適応となるしくみが確立されている。 例えば、卵巣がんに対するパクリタキセルという抗がん剤は3週に1回の投与方法として、承認・保険適応になっている治療方法である。 3週に1度の投与方法と週1度(毎週)の投与方法とを比較した臨床試験(治験ではなく医師主導の臨床試験)を日本の多施設共同試験として行い、週1度の投与方法が生存率を向上させた結果を発表した(Lancet 2009; 374: 1331-38)。 パクリタキセル週1度投与方法は、世界のどこの国でも薬事承認はされていないが、この日本の臨床試験の結果をもって、ほとんどの国で保険償還可能となっている現状にある。
先日、国際シンポジウムのために来日した英国ユニバーシティ・カレッジ・ロンドン腫瘍内科教授のジョナサン・レダーマン氏と話す機会があったが、英国では、「NICE(英国立医療技術評価機構)では承認していないが、臨床試験での使用は正式に認めているし、各医療機関での使用は、Lancetの論文があるから、と言うと保険適応になる」とのことであった。 こういったしくみは、ドイツ、韓国、台湾、中国でも同様で、週1度のパクリタキセルは保険対応可能ということである。 米国は、もう少し制度が整備されている。 法律(Social Security Act Title XVIII Sec 1861 (t))で、適応外使用については、世界的に認知されている学術雑誌(主要23誌)に掲載された治験以外の臨床試験成績にもとづいて、保険での薬剤費償還の判断がなされる、との規定がされており、前回のMRIC vol.87にも書いたように、コンペンディアという薬剤一覧集に掲載があるものは、保険償還されるしくみになっている。
海外では、要は、薬事承認と保険支払いは別になっており、適応外薬の対応方法として、主要な疾患に承認されたら、後は主要なpeer reviewジャーナルに載るような臨床試験のエビデンスがあれば、順次保険適応とされるしくみが確立されている。 米国では、法律で、適応外薬は治験以外での臨床試験の何らかのエビデンスがあれば、保険(メディケア・メディケイドなどの公的保険を含む)償還を認めることが定められている。 具体的には、政府が指定した薬剤一覧に記載があるものは保険で認められる。 抗がん剤の例だと、NCCN(National Comprehensive Cancer Network)という全米21のがんセンターの代表が集まってつくったNPO団体があるが、NCCNは各種がんの治療ガイドラインの他、ガイドラインに基づいた薬剤一覧集(NCCN drugs & Biologics Compendium)を作成しており、ここに載せられた薬剤は、保険適応されることになるので、医師はガイドラインに載るような良いエビデンスをつくる(臨床試験をする)ことのモチベーションにもつながっている。 NCCNの薬剤一覧集は有効なエビデンスが出ると数ヶ月以内にすぐに更新されるので、日進月歩する抗がん剤の進歩にタイムリーに準拠し、患者さんへすぐに還元できるシステムとなっている。
国内で承認・販売されている薬剤を新たな疾患に使用する場合には、それが適応外となってしまうといった適応外薬の問題があります。 第3者機関あるいはその疾患に関する学会が評価し、認められた薬剤は適応外の承認を待たずに保険償還されるということは、欧米では普通に行われていることです。
薬価抑制
日本の国民皆保険制度では、保険財源での利潤追求が批判されるために、無駄をなくすという口実のもと、欧米と比べて、診療報酬や薬価がかなり低く抑えられている。 医療機関は、診療報酬の不足を補い、経営赤字を解消するため、卸問屋に対して医薬品の納入価格を下げるように要求する。 多数の医療機関から同様に要求があれば、卸問屋としても、納入価格を下げざるを得ない。 そして、納入価格が下がれば、保険上の薬価との差益(いわゆる「薬価差益」)が発生し、その分を、医療機関の損失補填に充てることができる。 しかし、マスコミが薬価差益で儲けるのはケシカランとネガティブ・キャンペーンを展開するなどしたため、毎年、実態価格調査に基づいた薬価改訂が行なわれるようになった。 その結果、納入価格が下がれば、薬価も下がるようになった。 薬価が下がれば、薬価差益が解消されるため、医療機関はさらなる値下げを要求する。 そうして、薬価は際限なく下がって行く。
類似薬効比較方式により算定された新薬(平成20年4月~平成21年9月収載分)の新薬算定時の比較薬に関する直近5年間の日本と欧米4ヶ国の価格推移
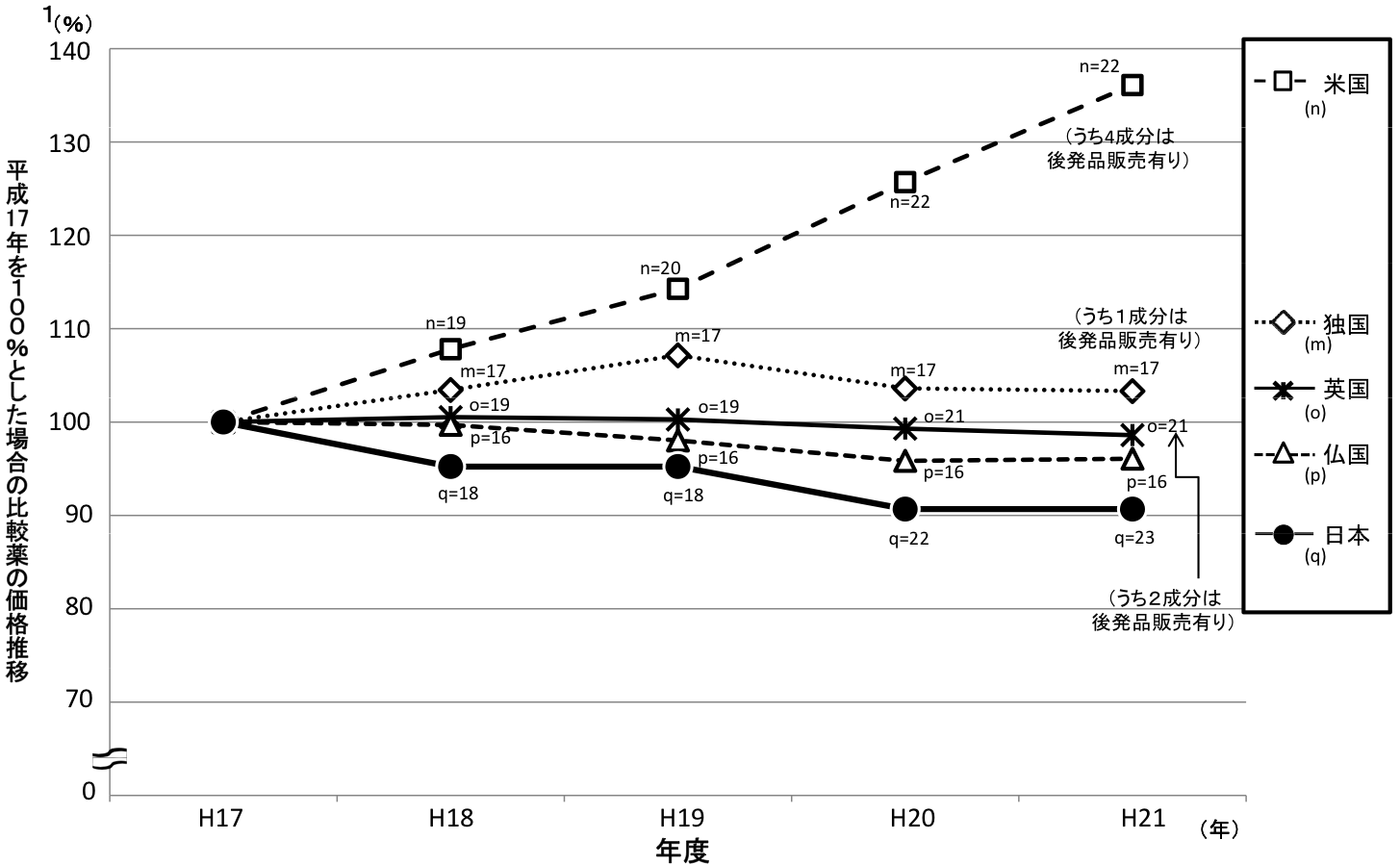
○平成21年9月18日中医協薬価専門部会提出資料「中医協薬‐4」の調査データから、平成17年の価格を100として、各国毎の価格の年次推移をプロットしたもの
後発品が初めて上市された先発品の前後5年間における日本と欧米4ヶ国における価格の推移
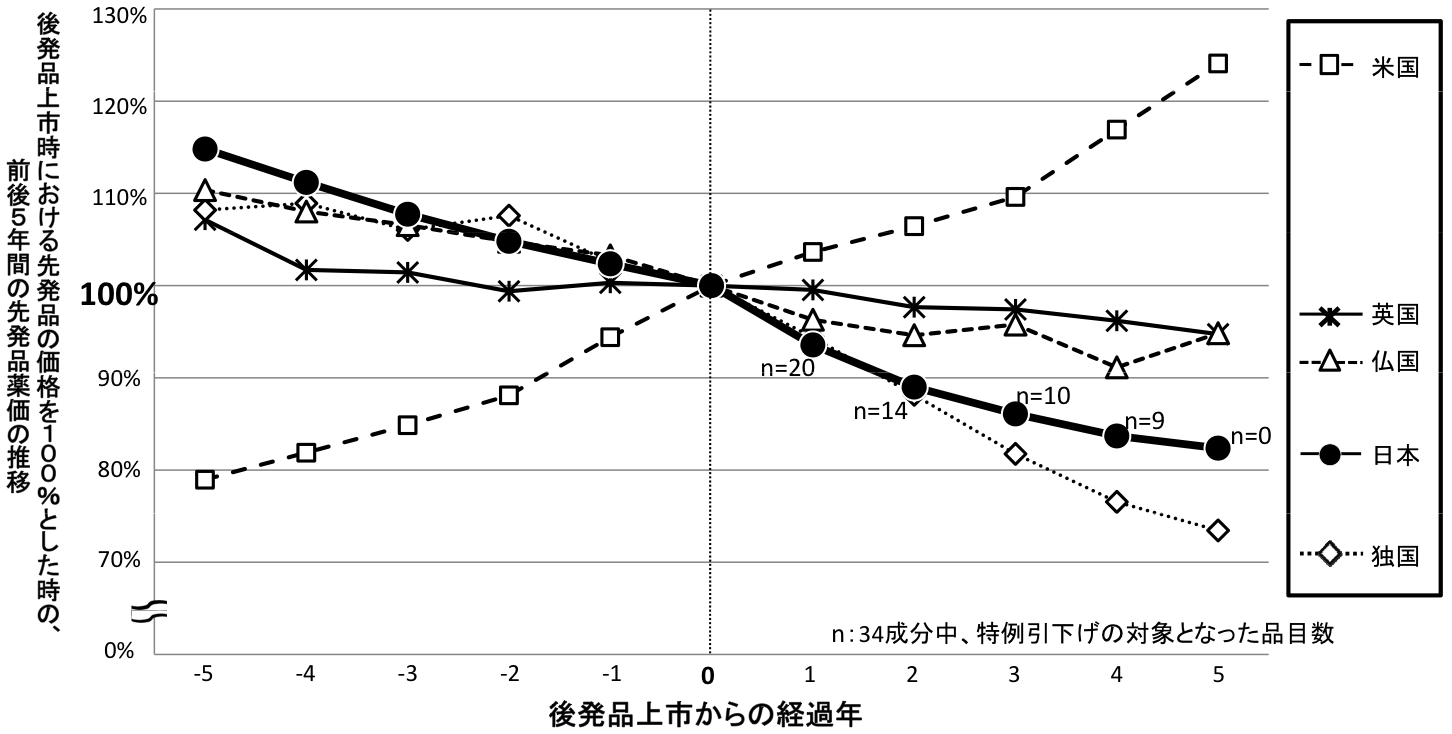
○平成14年度から平成17年度に日本で初めて後発品が薬価収載された新薬を対象とした(対象成分数:N=34)。
○日本では、後発品収載後、市場実勢価格による引下げに加え、約6~8%の特例引下げを実施している。
長期に亘り供給されている医薬品の価格推移(海外との比較)
長期に亘り供給されている古い医薬品について、欧米諸国においては過去10年間で価格が上昇あるいは横這いの傾向にあるが、日本においては価格が下落している。
価格推移の品目別内訳(2000年の価格を基準にした、2010年の価格推移)
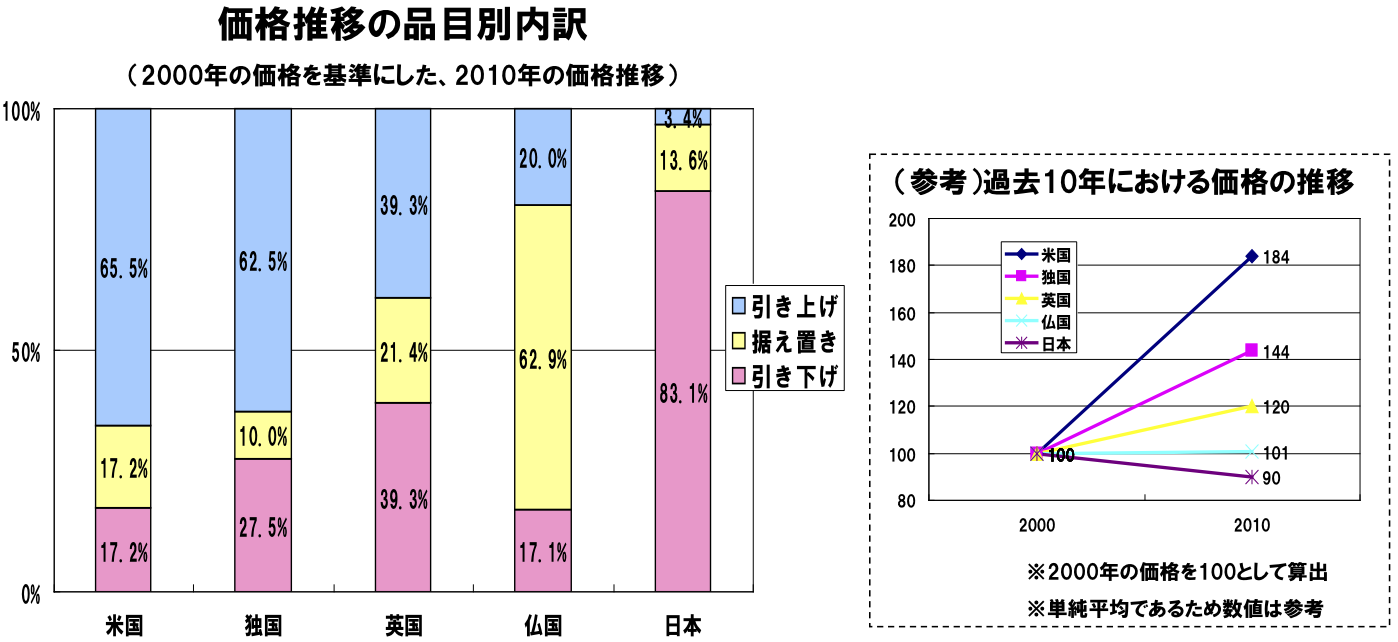
※調査対象は初発製剤が昭和42年以前より供給されている製品で、海外価格が把握できたもの(日本n=60、海外は国毎に把握数は異なる)
※指数が97~103を据え置きとした
際限なく薬価が下がれば、医薬品の開発費用が回収できない恐れがある。 開発費用が回収できないのでは、製薬会社も消極的になるだろう。
改革案
効能拡大
日本で、効能・効果毎の承認を求めるのは次のような理由による。
- インチキな治療法や、許容できない副作用のある治療法を排除する
- 保険財源の無駄使いの抑制
しかし、国が製造承認を行い、かつ、効能・効果の拡大に論文等の一定の科学的根拠を求めるなら、最初の製造承認のときだけ治験を行なえば良いはずである。
知的財産権制度
特許制度と医療制度の乖離に具体例を示す。
公知申請
現在、治験なしの申請を認める公知申請制度があるが、それは、製造または輸入承認済みの医薬品の適応拡大にのみ認められる制度である。 製造も輸入も認められていない新規の製造または輸入申請には使えない。
議論では,嘉山委員が,「この案では,ドラッグ・ラグの問題の解消にはつながらない」として,未承認薬も公知申請の対象とするよう要望.
これに対して,支払側は「未承認薬を公知申請の対象にするか否かは薬事法上の問題であり,中医協の役割を超えている」として難色を示し,遠藤久夫会長も同調したことから,適応外薬に関する今回の提案は了承することとし,未承認薬の問題に関しては,本年四月の診療報酬の改定時に導入された「新薬創出・適応外解消等促進加算」等の影響を見ながら引き続き議論していくことになった.
厚生労働省は、製造または輸入承認されていない医薬品については、責任の所在がはっきりしないことを理由に公知申請を認めていないのである。 しかし、オリジナルの製薬会社でなくても、ジェネリック医薬品の製薬会社であっても、製造または輸入の責任を果たすことは可能なはずである。 そして、新規の製造または輸入承認についても公知申請を認めれば、確実に、ドラッグ・レスを解消できる。 オリジナルの製薬会社にとっても、ジェネリック医薬品の製薬会社にとっても、治験をしなくて良いなら申請に掛かるコストは格安であり、自社で独占できなくても十分に利益が出せるはずなのである。
このページへのご意見は混合診療BBSにどうぞ。
メニュー
素晴らしき国民皆保険制度
医療制度問題
- 混合診療問題に関する誤解
- 混合診療より保険充実がまずありき(MRIC)
- ドラッグラグ・未承認薬の本質と改革案
- 小野俊介准教授による分析
- 使えない承認済医薬品
- 使い難い55年通知(適応外処方)
- 特許制度と医療制度の乖離
- 自由診療の問題
懸念事項
- 混合診療による国民皆保険崩壊の原理
- 混合診療に関わる医療利権
- インチキ療法蔓延の懸念
- 混合診療解禁の必要性はあるか?
それぞれの改革案
マスコミ報道等
- 混合診療社説と言う名のプロパガンダ
- 日本の薬価は高いのか?「薬価の国際比較調査にもとづく医療保険財源提案(薬価の国際比較-2010年薬価の比較調査報告書-)」
- まずは薬価全体を引き上げよ!ニボルマブ(オプジーボ)を下げる前に