特許制度と医療制度の乖離
我が国の特許制度
特許を取得するためには、新規性と進歩性が必要とされる。
特許法 第二十九条 産業上利用することができる発明をした者は、次に掲げる発明を除き、その発明について特許を受けることができる。
一 特許出願前に日本国内又は外国において公然知られた発明
二 特許出願前に日本国内又は外国において公然実施をされた発明
三 特許出願前に日本国内又は外国において、頒布された刊行物に記載された発明又は電気通信回線を通じて公衆に利用可能となつた発明
2 特許出願前にその発明の属する技術の分野における通常の知識を有する者が前項各号に掲げる発明に基いて容易に発明をすることができたときは、その発明については、同項の規定にかかわらず、特許を受けることができない。
第二十九条の二 特許出願に係る発明が当該特許出願の日前の他の特許出願又は実用新案登録出願であつて当該特許出願後に第六十六条第三項の規定により同項各号に掲げる事項を掲載した特許公報(以下「特許掲載公報」という。)の発行若しくは出願公開又は実用新案法(昭和三十四年法律第百二十三号)第十四条第三項の規定により同項各号に掲げる事項を掲載した実用新案公報(以下「実用新案掲載公報」という。)の発行がされたものの願書に最初に添付した明細書、特許請求の範囲若しくは実用新案登録請求の範囲又は図面(第三十六条の二第二項の外国語書面出願にあつては、同条第一項の外国語書面)に記載された発明又は考案(その発明又は考案をした者が当該特許出願に係る発明の発明者と同一の者である場合におけるその発明又は考案を除く。)と同一であるときは、その発明については、前条第一項の規定にかかわらず、特許を受けることができない。 ただし、当該特許出願の時にその出願人と当該他の特許出願又は実用新案登録出願の出願人とが同一の者であるときは、この限りでない。
(発明の新規性の喪失の例外)
第三十条 特許を受ける権利を有する者が試験を行い、刊行物に発表し、電気通信回線を通じて発表し、又は特許庁長官が指定する学術団体が開催する研究集会において文書をもつて発表することにより、第二十九条第一項各号の一に該当するに至つた発明は、その該当するに至つた日から六月以内にその者がした特許出願に係る発明についての同条第一項及び第二項の規定の適用については、同条第一項各号の一に該当するに至らなかつたものとみなす。
2 特許を受ける権利を有する者の意に反して第二十九条第一項各号の一に該当するに至つた発明も、その該当するに至つた日から六月以内にその者がした特許出願に係る発明についての同条第一項及び第二項の規定の適用については、前項と同様とする。
3 特許を受ける権利を有する者が政府若しくは地方公共団体(以下「政府等」という。)が開設する博覧会若しくは政府等以外の者が開設する博覧会であつて特許庁長官が指定するものに、パリ条約の同盟国若しくは世界貿易機関の加盟国の領域内でその政府等若しくはその許可を受けた者が開設する国際的な博覧会に、又はパリ条約の同盟国若しくは世界貿易機関の加盟国のいずれにも該当しない国の領域内でその政府等若しくはその許可を受けた者が開設する国際的な博覧会であつて特許庁長官が指定するものに出品することにより、第二十九条第一項各号の一に該当するに至つた発明も、その該当するに至つた日から六月以内にその者がした特許出願に係る発明についての同条第一項及び第二項の規定の適用については、第一項と同様とする。
4 第一項又は前項の規定の適用を受けようとする者は、その旨を記載した書面を特許出願と同時に特許庁長官に提出し、かつ、第二十九条第一項各号の一に該当するに至つた発明が第一項又は前項の規定の適用を受けることができる発明であることを証明する書面を特許出願の日から三十日以内に特許庁長官に提出しなければならない。
法第二十九条第一項各号により、次の発明は特許が認められない(新規性の喪失)。
- 公然知られた発明
- 公然実施をされた発明
- 頒布された刊行物に記載された発明
- 電気通信回線を通じて公衆に利用可能となつた発明
ただし、パリ条約を履行するための例外が定められており、特許権者自身が論文等で発表してから6ヶ月以内であれば例外として扱われる。 また、法第二十九条第二項により、「特許出願前にその発明の属する技術の分野における通常の知識を有する者が前項各号に掲げる発明に基いて容易に発明をすることができた」(進歩性がない)場合も特許が認められない。 医薬品部門における特許には次のような種類があるとされるが、いずれであっても新規性と進歩性の規定は適用される。
- 物質特許:化合物そのものの特許。製造方法が違っても物質が同じであれば特許の権利が及びます。一般式や化学名で物質が規定されます。
- 製法特許:化合物の製造方法の特許。物質が同じでも製造方法が異なっていれば、特許の権利は及びません。
- 例:化合物Aと化合物Bを反応させて、化合物Cを得る方法。
- 用途特許:物質の新しい用途についての特許。違った用途に使うときは権利は及びません。
- 例1:化合物Aを有効成分として含有する抗潰瘍剤。
- 例2:爆薬としてのニトログリセリンが公知でも、狭心症の治療薬として知られていない場合は、「ニトログリセリンを有効成分として含有する狭心症治療剤」として権利取得が可能。この場合、特許の効力は、爆薬のニトログリセリンの使用については、権利が及びません。
- 製剤特許:製剤の処方内容の特許。添加する物質に特徴があるとき特許となり得ます。
- 例1:有効成分Aに添加剤BとCを配合した徐放性製剤。
- 例2:有効成分Aに添加剤BとCを配合した口腔内崩壊錠。
- 遺伝子関連特許:アミノ酸配列やDNA配列も特許となり得ます。
- その他にも、診断薬の特許、測定法の特許、ビジネスモデルの特許などもあります。
※平成21年11月より特許庁は、特許・実用新案審査基準を改訂し、医薬品の新たな用法・用量が特許として認められるようになりました。
2001年10月以降に出願した特許は、出願から3年以内に審査請求しなければ無効となる。
特許出願について、出願審査の請求をすることができる期間は、平成13年10月1日より、これまでの「7年以内」から『3年以内』に変更されます。(特許法第48条の3) 出願審査請求期間の改正のお知らせ - 特許庁
特許を取得するには次のような経費が必要である。
- 出願するだけで15,000円取られる。
- 審査請求すると168,600円+(請求項の数×4,000円)取られる。
- 審査に通った後は毎年の特許料(登録料)を払わないと無効。
- 登録期間が長いほど料金が上がる。
- たとえば、1年目は2,300円+(請求項の数×200円)、10年以降は61,600円+(請求項の数×4,800円)。
薬事承認と特許の関係
他社が特許を取っている場合、その特許が切れるまでは後発医薬品を申請しても承認されない。
1.後発医薬品の薬事法上の承認審査にあたっては次のとおり取り扱うこと。なお、以下について、特許の存否は承認予定日で判断するものであること。
(1)先発医薬品の有効成分に特許が存在することによって、当該有効成分の製造そのものができない場合には、後発医薬品を承認しないこと。
(2)先発医薬品の一部の効能・効果、用法・用量(以下、「効能・効果等」という。)に特許が存在し、その他の効能・効果等を標ぼうする医薬品の製造が可能である場合については、後発医薬品を承認できることとすること。 この場合、特許が存在する効能・効果等については承認しない方針であるので、後発医薬品の申請者は事前に十分確認を行うこと。
(3)なお、効能・効果等の開発に伴い、既に製造販売の承認を与えられている医薬品と明らかに異なる効能・効果等が認められた医薬品等については、原則として、4年間の再審査期間を付すこと等とされているので、申し添える。
医薬品の特許費用
既に説明したとおり、1件の特許を維持するだけでも結構なお金が掛かる。 そして、特許は各国毎に取らなければならないので、特許を取る国が増えれば、それだけ余計にお金が掛かる。
医薬品の開発成功率は
候補化合物でみた成功確率はわずか11,300分の1(=0.009%)
医薬品産業ビジョン - 厚生労働省
新薬の開発成功率は約6000分の1
1つの新薬をつくるのにかかる費用は? - 日本製薬工業協会
とされる。
これら候補物質全ての特許を維持していたらお金が湯水の様に消えて行ってしまう。
だから、承認の見込みの候補物質はさっさと権利放棄しないと巨額の損失が発生してしまう。
例えば、全ての候補物質の審査請求を行なうと、審査請求代だけで成功1例につき約10億円を要する。
例えば、100国で同じことを行なえば、1千億円も掛かってしまう。
だから、損失を防ぐため、発売予定の無い国では、出願や審査請求を見送る場合もある。
中小のベンチャー企業が開発する医薬品の場合は、自国内でしか出願や審査請求を行なわないことも少なくないだろう。
たとえば、出願や審査請求を見送った場合は数年で特許が無効になってしまう。
- 他人に先に出願されると無効(パリ条約により、他国の出願から1年以内であれば優先権が認められる)。
- 公知になってから出願しても無効(パリ条約により、論文掲載や他国の出願内容の公表による場合等は6ヶ月以内であれば出願が認められる)。
- 出願してから3年以内に審査請求しないと無効(以前は7年)。
- 第三者の不服申立てに対して負けが確定すると無効。
特許は一度でも無効になれば、再度、取ることはできない。 無効になった後に、再度、特許を取りたいと思っても手遅れなのである。 成功の見込みがないと判断して特許権を放棄した後に、成功の見込みが出てきても遅いのである。
実例
癌に対する標準治療薬並びに二次薬 - がんと共に生きる会によれば、2001年2月現在の未承認薬にカルチノイド腫瘍のストレプトゾシンがある。 「標準治療薬並びに二次薬」のリストに載っているということは、その時点で「公然知られた発明」「公然実施をされた発明」になっているということである。 つまり、用途特許を取る場合の審査請求の期限は、2008年7月末以前であるはずである。 特許庁の公開テキスト検索にて、特許公報の要約+請求の範囲をstreptozocinで検索すると0件、ストレプトゾシンで検索すると11件が表示された。
| 公報番号 | 発明の名称 | 「カルチノイド腫瘍」の文言 |
|---|---|---|
| 特許4823060 | TWEAK受容体のマルチマー化およびオリゴマー化可溶性断片に関する組成物および方法 | なし |
| 特許4799864 | サイクリン依存性キナーゼインヒビターとしてのイミダゾピラジン | なし |
| 特許4790265 | サイクリン依存性キナーゼインヒビターとしての新規ピラゾロピリミジン | なし |
| 特許4755972 | 短鎖干渉RNA(siRNA)アナログ | あり |
| 特許4676701 | ドラッグデリバリー用バッキーサム又はカーボンナノチューブの使用方法 | なし |
| 特許4587626 | TEKアンタゴニスト | なし |
| 特許4571969 | キナーゼインヒビターとしてのピラゾロトリアジン | なし |
| 特許4563171 | 中和ヒト抗IGFR抗体 | あり |
| 特許4390845 | 薬物送達のためのポリマーミセル | なし |
| 特許3461000 | ヘテロベシキュラー・リポゾーム | なし |
| 特許3354185 | 活性剤の制御放出装置およびその製造方法 | なし |
ざっと見たところ、いずれも、物質特許、製法特許、用途特許(カルチノイド腫瘍)ではないようだ。 検索用語が不適切だから、特許情報が出てこないのか。
2010年4月27日の第3回 医療上の必要性の高い未承認薬・適応外薬検討会議の資料4-5「医療上の必要性に係る基準」への該当性に関する専門作業班(WG)の評価P.21によれば、転移を有する悪性内分泌腫瘍・神経内分泌腫瘍・カルチノイド腫瘍においてアメリカとフランスで承認済みだが、日本では開発すらされていない。
仮に、カルチノイド腫瘍について用途特許が取られているとするならば、2008年7月末までに審査請求がされていなければならない。
治験開始の検討要請中(2007/6/21現在)
検討要請中(ライセンス交渉中)(2008/9/29現在)
ストレプトゾシン - がん情報サービス
という状況から見て、交渉がまとまる前に見切発車で審査請求代(168,600円)を払って審査請求しない限り期限には間に合わない。
この文中の「ライセンス」が何を意味するのかは不明だが、時期的に見て、物質特許・製法特許・用途特許を指している可能性は低い。
仮に、用途特許等が取られたとするならば、交渉を始めてから審査請求をしているはずである。
何故なら、審査請求は出願よりも申請料金が高く、販売の目処が全くない医薬品の審査請求を行なっていては、経費が膨大になるからである。
確かに、1件だけなら168,600円だが、ストレプトゾシンだけ博打を打つ合理的理由はない。
ストレプトゾシン以外の販売の目処が全くない医薬品も含めて、全ての審査請求を行なっていては経費が膨大になる。
ただし、平成17年7月の「未承認薬使用問題検討会議」で
早期に治験が開始されるべき
「未承認薬使用問題検討会議」における検討終了から 6 ヶ月以上経過 後、治験が開始されていない品目について(照会の回答) -厚生労働省
とした日本の状況を知っていたなら、その段階での審査請求を行なってもおかしくはない。
とはいえ、特許出願の年月日も明らかではないので、その段階で審査請求が可能かどうかは不明である。
以上、まとめると、可能性としては次の3通りが考えられる。
- 日本では特許出願していない
- 審査請求が間に合わなかった
- 期限ギリギリで特許が取れた
以上、特許が取れていたとしても、特許切れになる一歩手前の事例である。 この事例も、審査請求の期限が3年となった現在の制度では間違いなく特許切れとなる。
特許切れ新薬
特許切れでも政府の要請に応じて製薬会社が新薬として開発するケースも少なからずあるようだ。
しかし、
企業をぶん殴ってドラッグラグを短期的になくすことと、長期的に日本の患者が幸せになることは、一致しない
ドラッグ・ラグ私たちが知っておくべき事・できる事 - NPO法人キャンサーネットジャパン
と東京大学医薬品評価学講座の小野俊介准教授は指摘する。
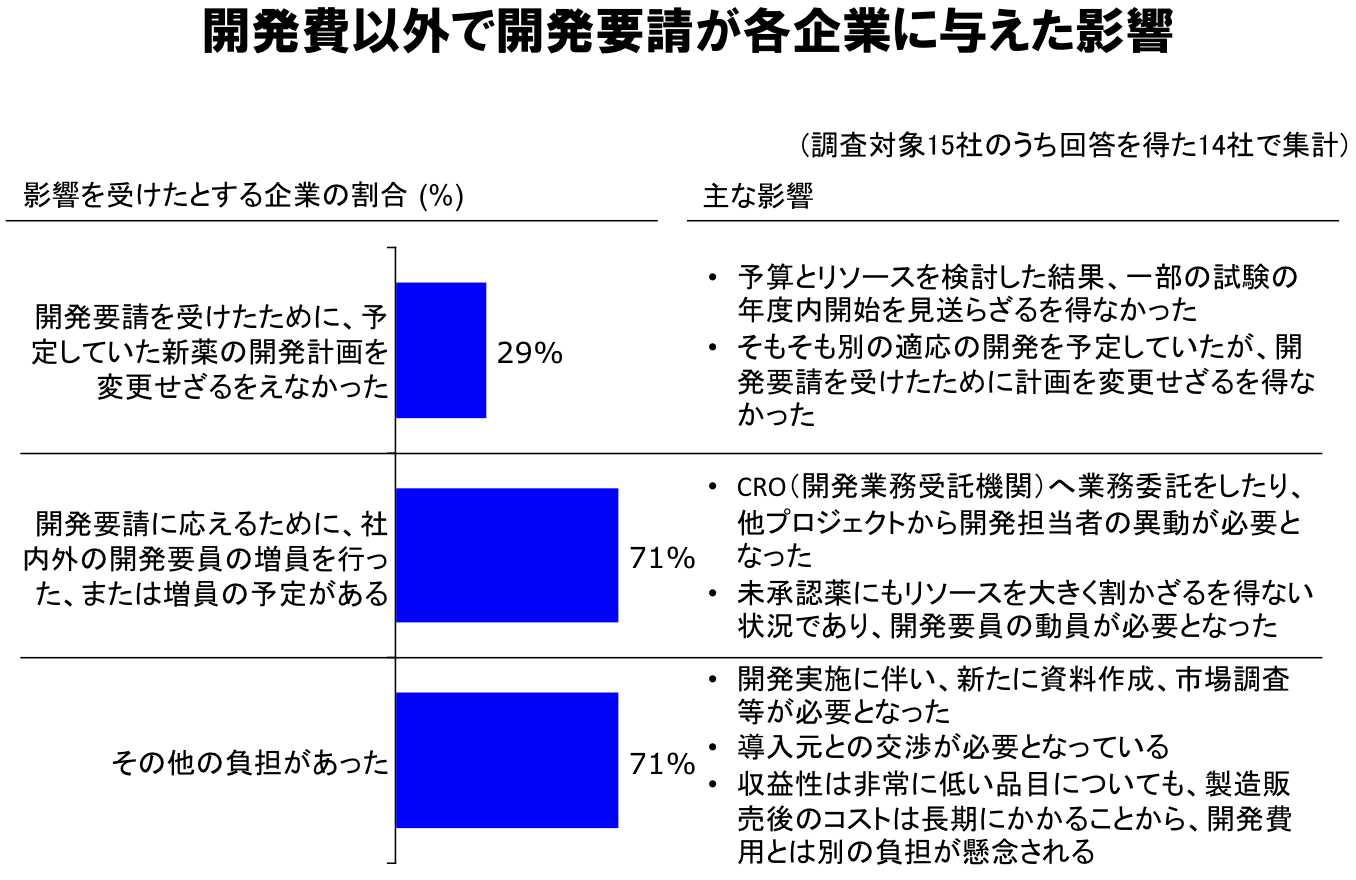
新薬創出・適応外薬解消等促進加算制度によって、このような要請に応じた製薬会社にはインセンティブが与えられることになったが、それにより他の新薬の開発計画に影響を与えている。
やはり、製薬会社の意向に反した要請を受け入れてもらうのではなく、製薬会社が心から開発したくなるような制度が必要だろう。
医療の実情にあった特許制度の在り方
特許権に限らず、知的財産権は全て、思いつきを保護する制度ではなく、知的財産を産む労力を保護するための制度である。 そして、医薬品を産む最大の労力は治験である。 しかし、現行の特許法は、治験の労力を保護する制度になっていない。 物質特許はもちろんのこと、治験の労力を保護する制度になっていない。 用途特許においても、新規性が特許の必須要件となる以上、非公知の用途でなければ保護されない。 外国で公知となった効能については、どんなにお金や労力を掛けて治験を行なっても、保護の対象とならないのである。 それは、知的財産権が本来あるべき姿から掛け離れている。 そして、それは、ドラッグラグ・未承認薬問題の解決を困難にする原因の1つとなり得る。 その問題を解決するためには、治験を保護対象とする新たな知的財産権が必要なのではないか。
- 治験実施登録後、一定期間の優先権を設定する。
- 同一成分の医薬品については、最初に治験実施登録を行なった者にのみ優先権を設定する。
- 優先権の設定期間内に医薬品の承認申請を行ない、かつ、承認された場合は、特許に準ずる権利として一定期間保護する。
- 優先権の設定期間が終了し、かつ、医薬品として承認されなかった場合は、その後、新たな治験実施登録を行なった者に一定期間の優先権を設定する。
- 特許を取得した医薬品については、新規製造承認後の特許期間の残期間分だけ、新制度の保護期間を減らす(二重保護の回避)。
- 製造承認済みの医薬品、および、医療上の必要性の乏しい医薬品については、この制度の対象としない。
- 新制度においては外国企業も国内企業と対等に扱う(パリ条約の遵守)。
メニュー
素晴らしき国民皆保険制度
医療制度問題
- 混合診療問題に関する誤解
- 混合診療より保険充実がまずありき(MRIC)
- ドラッグラグ・未承認薬の本質と改革案
- 小野俊介准教授による分析
- 使えない承認済医薬品
- 使い難い55年通知(適応外処方)
- 特許制度と医療制度の乖離
- 自由診療の問題
懸念事項
- 混合診療による国民皆保険崩壊の原理
- 混合診療に関わる医療利権
- インチキ療法蔓延の懸念
- 混合診療解禁の必要性はあるか?
それぞれの改革案
マスコミ報道等
- 混合診療社説と言う名のプロパガンダ
- 日本の薬価は高いのか?「薬価の国際比較調査にもとづく医療保険財源提案(薬価の国際比較-2010年薬価の比較調査報告書-)」
- まずは薬価全体を引き上げよ!ニボルマブ(オプジーボ)を下げる前に